Retinitis pigmentosa im Kontext erblicher
Netzhauterkrankungen
Netzhauterkrankungen

Seitennavigation
- Was versteht man unter erblichen Netzhauterkrankungen?
- Typische Symptome von erblichen Netzhauterkrankungen – Worauf ist zu achten?
- Der Aufbau des Auges – Was passiert bei erblichen Netzhauterkrankungen?
- Die Genetik erblicher Netzhauterkrankungen – welche Rolle spielt das Erbgut?
- Weitere erbliche Netzhauterkrankungen – Welche Merkmale haben die unterschiedlichen Krankheiten?
- Diagnose erblicher Netzhauterkrankungen – Welche Untersuchungen sind angezeigt?
- Vorteile von Gentests – Was müssen Patient:innen beachten?
- Forschung im Fokus – Welche Therapien gibt es für erbliche Netzhauterkrankungen?
- Eine mögliche Patient Journey
Was versteht man unter erblichen Netzhauterkrankungen?
Retinitis pigmentosa
Mit rund einem Fall pro 4.000 Menschen zählt die Retinitis pigmentosa (RP), auch Retinopathia pigmentosa, zu den häufigsten erblichen Netzhauterkrankungen und zu den häufigsten Ursachen für einen Sehverlust im mittleren Erwachsenenalter.4 In etwa 90% der Fälle ist die primäre Retinitis pigmentosa dafür ursächlich: Sie ist auf das Auge begrenzt und betrifft keine anderen Organe. Je nach Vererbungsweg werden drei Unterformen der familiär vererbten, primären Retinitis pigmentosa unterschieden:



Zusätzlich existieren Sonderformen der Retinitis pigmentosa, beispielsweise die assoziierte Retinitis pigmentosa, bei denen nicht nur die typischen ophthalmologischen Symptome auftreten, sondern z.B. Hör-, Stoffwechsel- und Herzrhythmusstörungen, krankhaftes Übergewicht oder Muskelschwäche hinzukommen können.6 Häufig sind diese Sonderformen mit anderen genetisch bedingten Syndromen assoziiert, darunter dem Usher- oder dem Bardet-Biedl-Syndrom.4,5
Typische Symptome von erblichen Netzhauterkrankungen – Worauf ist zu achten?
Ein Verdacht auf eine erbliche Netzhautdystrophie kann sich ergeben, wenn eine unklare Verschlechterung des Sehvermögens, unter anderem bei einer positiven Familienanamnese, eintritt oder sich charakteristische sichtbare Veränderungen der Netzhaut in der bildmorphologischen Diagnostik einstellen.1 Weitere Anzeichen können Farbsinn- oder Nachtsehstörungen, Verlust der Kontrastschärfe, Gesichtsfeldeinschränkungen bis hin zur Entwicklung eines Tunnelblicks, zunehmende Photophobie oder Nystagmus sein.1 Jede erbliche Netzhauterkrankung ist jedoch anders und so sind eines oder mehrere dieser Symptome möglich.
Krankheitsverlauf und Prognose der RP

Häufige Erstsymptome der Retinitis pigmentosa sind beispielsweise Nyktalopie (Nachtblindheit), Gesichtsfeldeinschränkung oder ein Verlust der Sehschärfe.7 Die Symptome verschlechtern sich zunehmend bis hin zur Erblindung, es handelt sich demnach um eine fortschreitende oder progressive Netzhautdystrophie. Erste Krankheitsanzeichen manifestieren sich meist innerhalb der ersten 30 Lebensjahre, allerdings ist vereinzelt auch ein späteres Eintreten von Symptomen erst nach dem 50. Lebensjahr möglich.4,7
Da für die Sehstörung zahlreiche andere Differenzialdiagnosen in Frage kommen können, müssen diese entsprechend identifiziert oder ausgeschlossen werden. So können beispielsweise bestimmte Medikamente, Entzündungsprozesse oder Autoimmunerkrankungen ähnliche Symptome verursachen.4,5
Der Aufbau des Auges – Was passiert bei erblichen Netzhauterkrankungen?
Die Netzhaut oder Retina ist aus Millionen hochspezialisierter lichtempfindlicher Zellen – so genannten Photorezeptoren – aufgebaut: Sie übernehmen beim visuellen Vorgang unterschiedliche Aufgaben.8,9 Stäbchen und Zapfen arbeiten innerhalb der Netzhaut zusammen, um visuelle Informationen zu sammeln. Lichtreize – d.h. elektromagnetische Wellen – werden in elektrische Impulse umgewandelt und über den Nervus opticus an den visuellen Cortex weitergeleitet, wo ein Abbild der Umwelt entsteht.9
Struktur der Retina
Im Laufe einer erblichen Netzhautdystrophie sterben diese Photorezeptoren ab. Je nach Erkrankung können unterschiedliche Zelltypen betroffen sein.1 Bei der Retinitis pigmentosa z.B. sind zunächst vorrangig Stäbchenzellen und erst im weiteren Verlauf auch Zapfenzellen betroffen.4,6
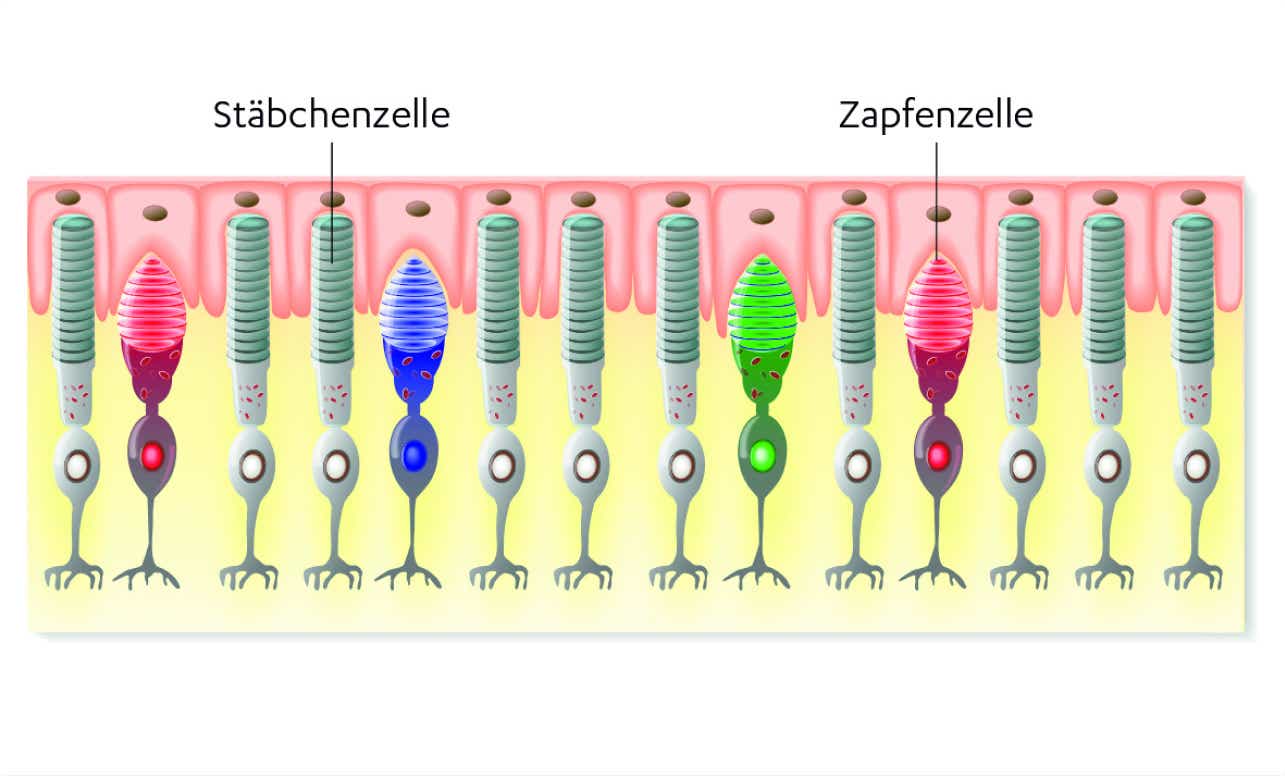
Stäbchenzellen
befinden sich überwiegend in den Randbereichen der Retina. Sie sind für die Hell-/Dunkelwahrnehmung, das Nacht- sowie das periphere Sehen zuständig.8
Zapfenzellen
befinden sich hauptsächlich im Zentrum der Retina, unter anderem in der fovea centralis der Makula, dem Ort des schärfsten Sehens. Sie sind für die Sehschärfe, das Sehen bei Tageslicht und das Farbensehen verantwortlich.8
Die Genetik erblicher Netzhauterkrankungen – welche Rolle spielt das Erbgut?
In den vergangenen 30 Jahren wurden über 270 Gene mit erblichen Netzhauterkrankungen in Verbindung gebracht.10 Allein für die Retinitis pigmentosa sind etwa 100 Gene und über 3.000 verschiedene Mutationen als potenzielle Auslöser der Erkrankung bekannt.4,5 Bestimmte Mutationen sind dabei häufig mit spezifischen vererbbaren Netzhauterkrankungen assoziiert.11-13 Unterschiedliche Mutationen im selben Gen können verschiedene Unterformen der betroffenen erblichen Netzhauterkrankung hervorrufen, während gleichzeitig ein und dieselbe Mutation zu unterschiedlichen klinischen Symptomen führen kann. Genetische Veränderungen können entweder de novo entstehen oder vererbt werden.
Allen relevanten Mutationen ist gemein, dass sie Gene betreffen, die für den visuellen Prozess essenziell sind. Störungen der betroffenen physiologischen Prozesse und ein Photorezeptor-Verlust sind die Folge. So können die Phototransduktion (Umwandlung des Lichtreizes in elektrische Signale), eine geregelte Zellentwicklung oder bestimmte Transportvorgänge durch Gen-Veränderungen beeinträchtigt sein.11-13
Beispielsweise codiert das ABCA4-Gen unter normalen Bedingungen ein Protein, das Cholesterol und andere Lipide aus der Retina hinaus befördert.14 Das RPGR-Gen, das bei der X-chromosomal vererbten Retinitis pigmentosa am häufigsten von einer pathologischen Veränderung betroffen ist, hingegen codiert ein Protein, das u.a. für den Transport von Eiweißen und anderen Biomolekülen innerhalb der Netzhaut verantwortlich ist.15
Weitere erbliche Netzhauterkrankungen – Welche Merkmale haben die unterschiedlichen Krankheiten?
Achromatopsie
Weltweit erkrankt von 30.000–50.000 Personen etwa eine an Achromatopsie, in Deutschland sind knapp 3.000 Menschen betroffen.16,17 Die Achromatopsie gehört somit zu den seltenen Erkrankungen, auch Orphan Diseases genannt.18 Der Begriff Achromatopsie – oder Achromasie – bezeichnet das völlige Unvermögen, Farben voneinander zu unterscheiden.
Es handelt sich demnach um eine komplette Farbenblindheit: Betroffene können nur Hell und Dunkel bzw. Schwarz, Weiß und Grauabstufungen unterscheiden.16 Weitere häufige Symptome umfassen eine Photophobie, eine geringe Sehschärfe sowie ein Nystagmus. Meist treten diese Symptome in den ersten Lebensmonaten auf, die Erkrankung verläuft in der Regel stationär.16
Farbenblindheit
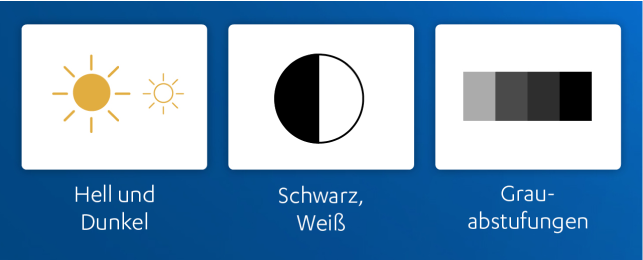
Häufige Symptome

Verschiedene genetische Mutationen sind als Ursache für die Achromatopsie bekannt, darunter Veränderungen in den Genen CNGA3 und CNGB3.19 Sie alle führen dazu, dass die Zapfenzellen ihre physiologischen Funktionen bei der Weiterleitung des elektrischen Impulses nicht adäquat ausüben können. Die Erkrankung folgt einem autosomal-rezessiven Vererbungsmuster, Frauen und Männer sind etwa gleich häufig betroffen.16,18
Andere IRDs (Auswahl)
Neben Retinitis pigmentosa und Achromatopsie sind weitere erbliche Netzhauterkrankungen bekannt, die sich in ihren Symptomen, Häufigkeiten und genetischen Ursachen unterscheiden.
Chorioideremie (CHM)20,21
Wird X-chromosomal vererbt und betrifft daher überwiegend biologische Männer, seltener Frauen
- Die Schwere der Symptomausprägung ist individuell unterschiedlich
- Bei betroffenen Frauen treten zwar immer strukturelle Netzhautveränderungen auf, oft aber keine oder nur geringe Funktionsstörungen
Ursache
Mutationen im CHM-Gen, die zu Defekten im intrazellulären Transport und somit zu Ein-schränkungen normaler (physiologischer) Zell-prozesse führen.
Prävalenz
ca. 1 von 50.000–100.000.
Symptome
Beginnend in den ersten beiden Lebensjahrzehnten Nachtblindheit und Verlust des peripheren Sehens, später Einschränkungen des zentralen Sehens und Verlust der Sehschärfe.
Morbus Stargardt (auch Stargardt Disease, STGD)24-26
Häufigste Form der Makuladegeneration im Jugendalter
- Je nach Zeitpunkt des Auftretens der Symptome werden drei Formen unterschieden: Beginn in der Kindheit (8.–14. Lebensjahr), im frühen oder im späten Erwachsenenalter
- Autosomal-rezessive und autosomal-dominante Vererbung möglich
Ursache
Häufig Mutationen im Gen ABCA4, seltener in den Genen CNGB3 oder ELOVL4, die zu fetthaltigen Ablagerungen im Bereich der Makula, dem Bereich des schärfsten Sehens, führen; weitere Gene sind bekannt.
Prävalenz
ca. 1 von 8.000–10.000.
Symptome
Progredienter Verlust des zentralen Sehens, Farbblindheit, Photophobie.
Leber‘sche Kongenitale Amaurose (LCA)22,23
Frühkindliche Netzhautdystrophie
- Sowohl autosomal-rezessiver als auch autosomal-dominanter Erbgang möglich
Ursache
Mutationen in verschiedenen Genen – darunter RPE65, CRX und AIPL1 – die unter physio-logischen Bedingungen für die Funktion oder Struktur von Photorezeptoren und versorgenden retinalen Pigmentzellen verantwortlich sind.
Prävalenz
ca. 1 von 33.000.
Symptome
Nachtblindheit, Photophobie, Nystagmus, Schielen, früher Sehverlust (Säuglingsalter).
Zapfen-Stäbchen-Dystrophie (engl. cone-rod dystrophy, CRD)27,28
Mehr als 30 bekannte Unterarten, die sich in ihrer genetischen Ursache und folglich in ihrem Vererbungsmuster (autosomal-rezessiv, autosomal-dominant, X-chromosomal) unterscheiden.
Entwickelt sich häufig in den ersten beiden Lebensjahrzehnten, betrifft die gesamte Netzhaut:
- Zunächst sterben Zapfenzellen ab, im weiteren Verlauf dann auch Stäbchenzellen
- Nicht zu verwechseln mit Stäbchen-Zapfen-Dystrophie, bei der erst Stäbchen, dann Zapfen absterben (prominentester Vertreter: Retinitis pigmentosa)
Ursache
Mutationen in mehr als 30 verschiedenen Genen sind als Auslöser bekannt, darunter solche, die mit anderen erblichen Netzhautdystrophien assoziiert sind.
Prävalenz
ca. 1 von 30.000–40.000.
Symptome
Reduzierte Sehschärfe, Photophobie und Schwierigkeiten, sich an wechselnde Licht-verhältnisse anzupassen, eingeschränktes Farbensehen, blinde Flecken im Sehzentrum, später Verlust des peripheren Sehens und Nachtsehstörungen, schließlich vollständige Erblindung.
Systemische Erkrankungen
Usher-Syndrom (USH)29,30
Gemäß klinischem Bild und genetischer Ursache erfolgt eine Differenzierung in drei Typen: USH1, USH2, USH3
- Alle werden autosomal-rezessiv vererbt
- USH2 kommt etwa doppelt so häufig vor wie USH1; USH3 ist sehr selten und bisher nur in Finnland und den USA nachgewiesen worden
Ursache
Veränderungen in Genen, die zu Veränderungen der Zellstruktur von Photorezeptoren und Haar-tzellen führen; mehr als 10 Gene als ursächlich bekannt
Prävalenz
ca. 1 von 6.000
Visuelle Symptome
fortschreitender Sehverlust, Nachtblindheit, Photophobie, Farbsehstörungen, Gesichtsfeldeinschränkungen, die letztlich in einem Tunnelblick resultieren; Auftreten erster visueller Symptome:
- bei USH1 im Kindesalter
- bei USH2 meist im Jugendalter
- bei USH3 ab dem mittleren Erwachsenenalter
Andere Symptome
- USH1: angeborene Taubheit, Gleichgewichtsstörungen
- USH2: konstant bleibende Schwerhörigkeit
- USH3: zunehmende Schwerhörigkeit
Bardet-Biedl-Syndrom (BBS)31,32
Symptome treten meist im frühen bis mittleren Kindesalter (<10 Jahre) auf und können sehr variabel sein; Vielfältigkeit und unterschiedliche Ausprägung erschweren häufig die klinische Diagnosestellung
- Autosomal-rezessive Vererbung
Ursache
Veränderungen in Genen, die zu strukturellen Veränderungen oder Funktionsstörungen in den so genannten Zilien – Fortsätzen auf der Oberfläche von Körperzellen – führen; mehr als 25 Gene, darunter BBS1 und BBS10, als ursächlich bekannt.
Prävalenz
ca. 1 von 140.000–160.000 in Nordamerika und Europa (kann in einigen geografischen Regionen gehäuft auftreten)
Visuelle Symptome
Nachtblindheit, Tunnelblick, ver-schwommenes zentrales Sehen, zunehmender Sehverlust bis hin zur Erblindung
Andere Symptome
Nierenfehlbildungen, krankhaftes Übergewicht und damit einhergehende Komplikationen wie Typ-2-Diabetes oder Hypertonie, Entwicklungsverzögerungen, Polydaktylie, Unterentwicklung der Geschlechtsorgane
Diagnose erblicher Netzhauterkrankungen – Welche Untersuchungen sind angezeigt?

Bisher existieren für die Mehrheit der IRDs keine kurativen Therapien. Dennoch ist eine frühzeitige Diagnose wichtig, um rechtzeitig potenzielle symptomlindernde und die Progredienz verlangsamende Behandlungsstrategien eruieren zu können. So gibt es für einige Erkrankungen Hinweise, dass sich bestimmte Krankheitsfolgen frühzeitig besser behandeln lassen und dadurch die visuelle Funktion länger erhalten bleiben kann. Manchen Patient:innen ist eine Diagnosestellung auch wichtig, um zeitig Gewissheit zu haben und ihre Lebensplanung, z.B. die berufliche und famili�äre Planung, entsprechend anpassen zu können.33,34 Unter Umständen besteht außerdem auch die Möglichkeit einer Teilnahme an klinischen Studien mit experimentell therapeutischen Ansätzen.
Je nach individueller Situation des/der Betroffenen können sehr unterschiedliche Fachgruppen an der Diagnose und Verlaufskontrolle einer erblichen Netzhauterkrankung beteiligt sein. Die wichtigste Gruppe sind die Ophthalmolog:innen, einschließlich der Spezialist:innen für Retina-Erkrankungen, jedoch können auch Fachärzt:innen für Humangenetik oder Pädiatrie, Allgemeinmediziner:innen und Optometrist:innen involviert sein.35 Im Falle einer syndromalen Erkrankung können zudem Neuolog:innen, Endokrinolog:innen oder Kardiolog:innen eine Rolle spielen.

Zwischen Symptombeginn und genetisch gesicherter Diagnose können mitunter mehrere Monate bis Jahre vergehen.35 Dies kann gerade bei schnellem Fortschreiten, Kinderwunsch oder Vorliegen einer Erkrankung mit bereits bestehenden Therapieoptionen für Betroffene teils erhebliche negative Konsequenzen bedeuten.35
Die Diagnose von IRDs ist im Wesentlichen zweigeteilt: klassische augenärztliche werden ergänzt durch weitere Untersuchungen. Da sich die Symptome unterschiedlicher ophthalmologischer Erkrankungen überschneiden können, kommt einer ausführlichen Differenzialdiagnostik eine besondere Bedeutung zu. Zusätzlich ist eine systemische Anamnese wichtig, da nicht-ophthalmologische Manifestationen auf das Vorliegen einer syndromalen Erkrankung hinweisen können.
Klassische augenärztliche Diagnostik
Ergänzende Untersuchungen
Molekulardiagnostik
Augenärztliche Untersuchungen
Die augenärztliche Diagnostik sollte mindestens folgende Untersuchungen beinhalten:33,36,37
- Anamnese: Befragung von Betroffenen oder Angehörigen zu Krankheitsgeschichte, ophthalmologischen sowie nicht-opthalmologischen Symptomen, Medikamenteneinnahme und eventuellen anderen betroffenen Familienmitgliedern
- Prüfung der Sehschärfe (Visus) sowie der Brechkraft der Linse
- Prüfung der Zusammenarbeit beider Augen zur Feststellung von Strabismus oder Nystagmus
- Ophthalmoskopie/Funduskopie: Untersuchung des Augenhintergrundes zur Feststellung sichtbarer Netzhautveränderungen, z.B. Gefäßverengungen, Atrophien oder Pigmentierungen
- Perimetrie: Untersuchung des Gesichtsfeldes
- Farbsinnprüfung zur Feststellung von Störungen des Farbensehens
- Untersuchung der Dunkeladaption zur Feststellung der Anpassungsgeschwindigkeit an verschiedene Lichtverhältnisse
Ergänzende Untersuchungen
Um einen eindeutigen Krankheitsbefund zu erhalten, sind häufig ergänzende Untersuchungen notwendig.33,36,37
- Elektrophysiologie: Messung der elektrischen Aktivität im Auge
- Elektroretinogramm: zur Feststellung von Funktionsstörungen der Retina (Untersuchung der gesamten Netzhaut oder gezielte Untersuchung der Makula möglich)
- Elektrookulogramm: zur Feststellung von Funktionsstörungen des retinalen Pigmentepithels
Molekulardiagnostik: Untersuchung auf mögliche ursächliche Mutationen
- Bildgebung der Retina
- Optische Kohärenztomographie (OCT): ermöglicht frühes Sichtbarmachen von Veränderungen der äußeren Netzhautschichten und der Pigmentschicht, selbst bei Unauffälligkeit des Augenhintergrunds in der Funduskopie
- Fundusautofluoreszenz und Nah-Infrarot-Autofluoreszenz: erlaubt die Darstellung bestimmter Stoffwechselprodukte im retinalen Pigmentepithel und die einfache Dokumentation der Pigmentschichtstruktur ohne Einsatz von Farbstoffen
Molekulardiagnostik
Gentests sind heutzutage zum Maßstab geworden, wenn es darum geht, eine genetische Ursache für die Beeinträchtigung oder den Verlust des Sehvermögens zu ermitteln: Bei bis zu 76% der Betroffenen mit einer erblichen Netzhauterkrankung kann ein Gentest bei der Identifizierung der genetischen Ursache helfen.37-39
Der Molekulardiagnostik kommt dabei eine große Bedeutung zu – einerseits im Kontext der eindeutigen Diagnostik sowie der damit verbundenen umfassenden Beratung von Betroffenen und deren Umfeld, andererseits vor dem Hintergrund bereits bestehender Therapieoptionen.35 Allerdings erhalten in der Mehrheit der nicht-universitären Kliniken gemäß einer aktuellen Umfrage weniger als 20% der Patient:innen mit einer erblichen Netzhauterkrankung eine molekulargenetische Diagnose.35 Inzwischen gibt es weltweit Bestrebungen, die genetische Testungsrate bei Patient:innen mit Verdacht auf eine erbliche Netzhauterkrankung zu erhöhen.
Der Nachweis von Genveränderungen kann mittels Next-Generation-Sequencing (NGS) oder Polymerase-Kettenreaktion (PCR) erfolgen. Je nach Methode lässt sich die NGS-Testung umfassend und flexibel einsetzen, ohne dass vorher Kenntnisse zur DNA-Sequenz nötig sind. Um Kosten und Zeit zu sparen, ist jedoch auch eine NGS-Analyse sogenannter Genpanels – bestimmter präspezifizierter Gene – möglich. In diesem Fall muss jedoch sichergestellt sein, dass die vermuteten IRD-Gene durch das gewählte Panel auch tatsächlich abgedeckt werden. PCR-Verfahren sind in der Regel einfacher und preisgünstiger als die NGS-Testung, eignen sich allerdings nur für die Untersuchung weniger vordefinierter Zielsequenzen. So kann es sein, dass insbesondere seltene Mutationen nicht entdeckt werden.40
Vorteile von Gentests – Was müssen Patient:innen beachten?
Molekulardiagnostische Untersuchungen bieten im Kontext von IRDs eine Reihe von Vorteilen. Da sich wissenschaftliche Methoden und Erkenntnisse stetig weiterentwickeln, kann zudem auch eine Wiederholung des Gentests im Laufe einer Erkrankung sinnvoll sein.39
Patient:innen und Angehörige können unterschiedlich profitieren:39,41
Absicherung einer klinischen Verdachtsdiagnose, die wichtige Informationen über die Erkrankung und den voraussichtlichen Krankheitsverlauf liefert, darunter auch Hinweise auf mögliche gesundheitliche Auswirkungen auf andere Körperbereiche und eine daraus folgende Notwendigkeit der interdisziplinären Betreuung.
Je nach genetisch gesicherter Diagnose können Patient:innen von gezielter medizinischer Behandlung profitieren. Gentherapien setzen dabei eine Kenntnis der spezifischen Genveränderung voraus.
Durch Klärung des Vererbungsmodus kann gezielt auf Risiken für Verwandte bzw. (zukünftige) Nachkommen geschlossen werden.
Befähigt Menschen mit einer Netzhauterkrankung und ihre Familien, informierte Entscheidungen zur Familien- und Lebensplanung zu treffen. Diese Entscheidungen können die Lebensqualität von Betroffenen und Angehörigen verbessern, welche durch den fortschreitenden Sehverlust womöglich bereits stark beeinträchtigt ist.
Allerdings wird ein positiver Testbefund von Betroffenen oder Familienangehörigen unter Umständen als belastend empfunden. Aufgrund unvollständiger oder heterogener Penetranz manifestiert zudem nicht jede:r, der/die eine pathologische Genvariante trägt, auch tatsächlich die vollständige Erkrankung. Dementsprechend muss genau eruiert werden, ob der Patient oder die Patientin überhaupt wissen möchte, dass er oder sie erkranken könnte. Im Vorfeld ist daher eine humangenetische Beratung essenziell, um mögliche Sorgen, aber auch Risiken, Vorteile und Grenzen von Gentests zu besprechen.34,42

Geht der Augenarzt oder die Augenärztin davon aus, dass eine erbliche Netzhauterkrankung vorliegt, erfolgt in der Regel zunächst die Überweisung an eine:n Retina- bzw. IRD-Spezialist:in. Nach eingehender Untersuchung und bei begründeter Vermutung einer genetischen Ursache für die retinale Erkrankung sollte, nach Einwilligung des Patienten oder der Patientin, ein Gentest initiiert werden. Ein Facharzt oder eine Fachärztin für Humangenetik wird Fragen rund um den Gentest beantworten sowie nach Absprache mit dem Augenarzt oder der Augenärztin den geeigneten Test auswählen.42 Die Blutabnahme und das Einsenden der Probe an das Labor erfolgt ebenso durch den/die Humangenetiker:in, wie die Interpretation der Ergebnisse.34
Ein Gentest erfolgt immer auf freiwilliger Basis. Es gelten das Selbstbestimmungsrecht, der Gleichheitsgrundsatz, das Recht auf vollständige Information und das Recht auf Nichtwissen.43,44
Eine molekulargenetische Untersuchung wird in der Regel von der Krankenkasse übernommen.45 Gesetzlich Versicherte benötigen dabei keinen Kostenvoranschlag, die genetische Analyse ist eine kassenärztliche Leistung nach dem einheitlichen Bewertungsmaßstab.46 Allerdings kann bei umfangreichen genetischen Untersuchungen eine vorherige Genehmigung durch die gesetzliche Krankenkasse sinnvoll sein. Privat Versicherte müssen sich hingegen vor Durchführung des Tests den Kostenvoranschlag des jeweiligen humangenetischen Institutes von ihrer Krankenkasse genehmigen lassen.34
Forschung im Fokus – Welche Therapien gibt es für erbliche Netzhauterkrankungen?
Für die überwiegende Mehrheit der IRDs existieren bislang keine Therapieoptionen, die zu einer Heilung führen oder die das Fortschreiten der Erkrankung aufhalten können.33,47,48 Nur für die Lebersche kongenitale Amaurose und die Retinitis pigmentosa, welche durch biallelische Mutationen im RPE65-Gen verursacht werden, gibt es derzeit eine zugelassene Gentherapie.49 Dabei wird das in einen viralen Vektor verpackte intakte Gen im Rahmen einer OP einmalig subretinal gespritzt. Die Viren schleusen die DNA in die retinalen Zellen ein (Transfektion) und das normale Gen übernimmt daraufhin die Funktion des mutierten Gens.49
Hilfsmittel wie Brillen und UV-Schutz-Gläser sowie Orientierungs- und Mobilitätstrainings können dabei helfen, besser mit der Erkrankung umzugehen oder das alltägliche Leben zu erleichtern.33 Zudem können begleitend auftretende Komplikationen am Auge, bspw. Katarakt oder Makulaödem, behandelt und so das Sehvermögen häufig verbessert werden. Es gibt Hinweise, dass in seltenen Fällen auch eine spezielle Diät die Krankheit günstig beeinflussen kann. Bei einer psychologischen Belastung des/der Betroffenen können ergänzend u.a. Selbsthilfegruppen Unterstützung bieten.33
Die Wissenschaft entwickelt sich weiter – klinische Studien
Die zunehmende Sensibilisierung für erbliche Netzhauterkrankungen (IRDs) und der Bedarf an neuen effektiven Behandlungsoptionen für Patient:innen hat in den letzten Jahrzehnten dazu geführt, dass mehr und mehr wissenschaftliche Anstrengungen auf diesem Gebiet unternommen werden. Zahlreiche klinische Studien, die innovative Therapien zur Behandlung erblicher Netzhauterkrankungen untersuchen, laufen derzeit.50 An diversen weiteren Gen- und medikamentösen Therapien wird geforscht.
Verschiedene Ansätze für Gentherapien existieren derzeit:51
Bei der Genersatztherapie, auch Augmentationstherapie genannt, werden mithilfe von viralen oder nicht-viralen Vektoren normale Kopien des betroffenen Gens in die Retinazellen von Patient:innen eingeschleust.
Bei der Gen-Edierung wird die fehlerhafte Genvariante direkt in der Patient:innen-DNA korrigiert; das mutierte Gen wird ausgeschnitten und anschließend durch eine intakte Version ersetzt.
Bei der RNA-Edierung wird die (m)RNA von Patient:innen verändert; dies ermöglicht eine Veränderung fehlerhafter Varianten auf Transkript-Ebene.
Bei der Optogenetik werden andere Zellen der Retina (z.B. Ganglienzellen) dazu gebracht, die Funktionen von Photorezeptoren zu übernehmen.
Eine mögliche Patient Journey
Erbliche Netzhauterkrankungen sind zusammenfassend äußerst heterogene, teils komplex zu diagnostizierende und bisher schwierig zu behandelnde Krankheiten. Zwar können sich Patientenpfade je nach Erkrankung oder äußeren Gegebenheiten wie dem Wohnort und dem dadurch zur Verfügung stehenden ärztlichen Netzwerk individuell unterscheiden, dennoch lassen sich im Hinblick auf die Behandlung von Patient:innen mit IRDs drei grobe Abläufe unterscheiden.
Mögliche Patient Journey bei erblichen Netzhauterkrankungen
Kein Anspruch auf Vollständigkeit. Mod. nach52
Quellen
- S1-Leitlinie Erbliche Netzhaut-, Aderhaut- und Sehbahnerkrankungen. Registernummer 045–023. https://register.awmf.org/de/leitlinien/detail/045-023. Letzter Zugriff: 31.10.2023
- Cremers FPM, et al. Genes (Basel). 2018;9(4)t
- Psychologische Fragen. https://www.pro-retina.de/leben/alltag/psychologische-fragen. Letzter Zugriff: 31.10.2023
- Fakten zu Retinitis pigmentosa (RP). https://www.pro-retina.de/netzhauterkrankungen/krankheitsbilder/generalisierte-netz-aderhautdystrophien/retinitis-pigmentosa/fakten-zu-retinitis-pigmentosa-rp. Letzter Zugriff: 31.10.2023
- Retinopathia pigmentosa. https://www.pschyrembel.de/Retinopathia%20pigmentosa/K0JSP. Letzter Zugriff: 31.10.2023
- Martinez-Fernandez De La Camara C et al. Expert Opin Orphan Drugs 2018; 6(3):167–177
- Retinitis pigmentosa. https://medlineplus.gov/genetics/condition/retinitis-pigmentosa/. Letzter Zugriff: 31.10.2023
- Photorezeptor. https://flexikon.doccheck.com/de/Photorezeptor. Letzter Zugriff: 31.10.2023
- Zapfen und Stäbchen. https://studyflix.de/biologie/zapfen-und-stabchen-5396. Letzter Zugriff: 31.10.2023
- Branham K, et al. Am J Med Genet C Semin Med Genet. 2020;184(3):571-7
- Lee K und Garg S. Genet Med. 2015;17(4):245-52
- Genes implicated in photoreceptor disorders. https://www.aao.org/education/image/genes-implicated-in-photoreceptor-disorders. Letzter Zugriff: 31.10.2023
- Summaries of Genes and Loci Causing Retinal Diseases. https://web.sph.uth.edu/RetNet/sum-dis.htm. Letzter Zugriff: 31.10.2023
- Tsybovsky Y, Molday RS, and Palczewski K. Adv Exp Med Biol. 2010;703:105-25
- Megaw RD, Soares DC, and Wright AF. Exp Eye Res. 2015;138:32-41
- Achromatopsia. https://medlineplus.gov/genetics/condition/achromatopsia/. Letzter Zugriff: 31.10.2023
- Was ist eigentlich Farbblindheit? https://www.pro-retina.de/was-ist-eigentlich-farbblindheit. Letzter Zugriff: 31.10.2023
- ACHM. https://www.gelbe-liste.de/orphan-diseases/achm. Letzter Zugriff: 31.10.2023
- Achromatopsie (völlige Farbenblindheit): Ursache, Häufigkeit, Vererbung und Symptome. https://medizindoc.de/achromatopsie-voellige-farbenblindheit-ursache-haeufigkeit-vererbung-und-symptome/. Letzter Zugriff: 31.10.2023
- Fakten zur Chorioideremie. https://www.pro-retina.de/netzhauterkrankungen/krankheitsbilder/generalisierte-netz-aderhautdystrophien/chorioideremie-chm/fakten-zur-chorioideremie. Letzter Zugriff: 31.10.2023
- Choroideremia. https://medlineplus.gov/genetics/condition/choroideremia/. Letzter Zugriff: 31.10.2023
- Fakten zur Leber'schen Kongenitalen Amaurose (LCA). https://www.pro-retina.de/netzhauterkrankungen/krankheitsbilder/generalisierte-netz-aderhautdystrophien/lebersche-kongenitale-amaurose-lca/fakten-zur-leberschen-kongenitalen-amaurose-lca. Letzter Zugriff: 31.10.2023
- Leber congenital amaurosis. https://medlineplus.gov/genetics/condition/leber-congenital-amaurosis/. Letzter Zugriff: 31.10.2023
- Stargardt macular degeneration. https://medlineplus.gov/genetics/condition/stargardt-macular-degeneration/. Letzter Zugriff: 31.10.2023
- Stargardt Disease. https://www.nei.nih.gov/learn-about-eye-health/eye-conditions-and-diseases/stargardt-disease. Letzter Zugriff: 31.10.2023
- Morbus Stargardt, NGS-Panel. https://www.medizin-zentrum-dortmund.de/de/laboratoriumsmedizin/untersuchungsprogramm/untersuchung/4329/. Letzter Zugriff: 31.10.2023
- Cone-rod dystrophy. https://medlineplus.gov/genetics/condition/cone-rod-dystrophy/. Letzter Zugriff: 31.10.2023
- Fakten zur Zapfen-Stäbchen-Dystrophie. https://www.pro-retina.de/netzhauterkrankungen/krankheitsbilder/generalisierte-netz-aderhautdystrophien/zapfen-staebchen-dystrophie-zsd/fakten-zur-zapfen-staebchen-dystrophie. Letzter Zugriff: 31.10.2023
- Fakten zum Usher-Syndrom. https://www.pro-retina.de/netzhauterkrankungen/krankheitsbilder/syndrome/usher-syndrom/fakten-zum-usher-syndrom. Letzter Zugriff: 31.10.2023
- Usher syndrome. https://www.nei.nih.gov/learn-about-eye-health/eye-conditions-and-diseases/usher-syndrome. Letzter Zugriff: 31.10.2023
- Bardet-Biedl syndrome. https://medlineplus.gov/genetics/condition/bardet-biedl-syndrome/. Letzter Zugriff: 31.10.2023
- Fakten zu BBS. https://www.pro-retina.de/netzhauterkrankungen/krankheitsbilder/syndrome/bardet-biedl-syndrom-bbs/fakten-zu-bbs. Letzter Zugriff: 31.10.2023
- Erbliche Netzhauterkrankungen der Augen. https://www.patienten-information.de/kurzinformationen/erbliche-netzhauterkrankungen. Letzter Zugriff: 31.10.2023
- Die Molekulargenetische Diagnostik: In 5 Schritten zum Befund https://www.pro-retina.de/fileadmin/user_upload/5._Medien_oeffentlich/2._Allgemeines_und_Hilfsmittel/5_Schritte_zur_molekulargenetischen_Diagnostik_Einzelseiten_UA.pdf. Letzter Zugriff: 31.10.2023
- Kunzel SH, et al. Ophthalmologie. 2023
- Untersuchungsmethoden. https://www.pro-retina.de/netzhauterkrankungen/untersuchungsmethoden. Letzter Zugriff: 31.10.2023
- Guidelines on Clinical Assessment of Patients With Inherited Retinal Degenerations. https://www.aao.org/education/clinical-statement/guidelines-on-clinical-assessment-of-patients-with. Letzter Zugriff: 31.10.2023
- Tatour Y und Ben-Yosef T. Diagnostics (Basel). 2020;10(10)
- Guidelines for the assessment and management of patients with inherited retinal diseases (IRD). https://ranzco.edu/wp-content/uploads/2020/05/RANZCO-Guidelines-for-the-assessment-and-management-of-patients-with-inherited-retinal-diseases-IRD.pdf. Letzter Zugriff: 31.10.2023
- Methoden der genetischen Laboruntersuchung. https://www.humangenetik-regensburg.de/methoden.html. Letzter Zugriff: 31.10.2023
- Großer Schritt für die Patienten genetisch bedingter Netzhauterkrankungen. https://www.pro-retina.de/grosser-schritt-fuer-die-patienten-genetisch-bedingter-netzhauterkrankungen. Letzter Zugriff: 31.10.2023
- Genetic counselling. https://retinauk.org.uk/genetics/genetic-counselling/. Letzter Zugriff: 31.10.2023
- Gesetz über genetische Untersuchungen bei Menschen (Gendiagnostikgesetz). https://www.gesetze-im-internet.de/gendg/index.html. Letzter Zugriff: 31.10.2023
- Positionspapier der Deutschen Gesellschaft für Humangenetik e.V. https://www.gfhev.de/de/veroeffentlichungen/p-2007_gfh_positionspapier.pdf. Letzter Zugriff: 31.10.2023
- Kellner U, et al. Ophthalmologie. 2022;119(8):820-6
- Pressemitteilung: ENTGRENZUNG DER ABRECHNUNGSZIFFER BEI MOLEKULARGENETISCHER DIAGNOSE. http://www.service-auge.de/2021/03/02/entgrenzung-der-abrechnungsziffer-bei-molekulargenetischer-diagnose/. Letzter Zugriff: 31.10.2023
- Retinopathia pigmentosa. https://flexikon.doccheck.com/de/Retinopathia_pigmentosa. Letzter Zugriff: 31.10.2023
- Therapien bei Netzhauterkrankungen. https://www.pro-retina.de/forschung/therapie. Letzter Zugriff: 31.10.2023
- Luxturna (Voretigen Neparvovec). https://www.ema.europa.eu/en/documents/overview/luxturna-epar-medicine-overview_de.pdf. Letzter Zugriff: 31.10.2023
- The Latest in Gene Therapy Clinical Trials for IRD. https://retinatoday.com/articles/2023-july-aug/the-latest-in-gene-therapy-clinical-trials-for-ird. Letzter Zugriff: 31.10.2023
- Fenner BJ, et al. Front Genet. 2021;12:794805
- Inherited retinal diseases – the patient journey. https://www.insightnews.com.au/inherited-retinal-diseases-the-patient-journey/. Letzter Zugriff: 31.10.2023