Tumoragnostische Ansätze
Wenn es mehr um das Wie als das Wo geht
Wenn es mehr um das Wie als das Wo geht

Tumoragnostische Ansätze
Wenn es mehr um das Wie als das Wo geht
Bestimmte molekulare Alterationen können bei unterschiedlichen Entitäten gleichermaßen auftreten.1 Diese Erkenntnis hat dazu geführt, dass wir heute bestimmte Genveränderungen Histologie-übergreifend untersuchen und dementsprechend auch Entitäts-unabhängige, sogenannte tumoragnostische Therapien entwickeln. Der tumoragnostische Ansatz verspricht vor allem bei seltenen Krebserkrankungen und kleineren Subgruppen onkologischer Indikationen mit großem Bedarf an neuen Therapieoptionen ein hohes Potenzial, die Versorgungslage für diese Patientengruppe zu verbessern. Mittlerweile sind mehrere molekulare Marker identifiziert worden, die für tumoragnostische Therapieansätze in Frage kommen. Bislang sind in den USA zwei Wirkstoffe zur tumoragnostischen Therapie solider Tumoren mit einer hohen Mikrosatelliten-Instabilität oder Defekten in der Mismatch-Reparatur bzw. mit NTRK-Genfusionen zugelassen.1
Das zunehmende Verständnis der molekularen Abläufe in Tumorzellen hat in den letzten Jahren unter anderem durch das „Next Generation Sequencing (NGS)“ dazu beigetragen, dass bestimmte Genveränderungen als Treiber für die Entstehung von Krebs und das Tumorwachstum identifiziert werden konnten.2,3 Vor diesem Hintergrund wurden die durch Genalterationen hervorgerufenen Entgleisungsprozesse und die zugrundeliegenden Signalwege diverser Tumoren besser verstanden. Dadurch wurden zunehmend gezielte(re) Angriffspunkte für Krebstherapien bestimmt/erkannt und werden auch weiterhin untersucht. So konnten bei einigen Krebsarten spezifische molekulare Biomarker erfolgreich als Ziele für therapeutische Ansätze identifiziert werden, um im Sinne der Präzisionsonkologie vielversprechende Ergebnisse zu erzielen. (Mehr zum Thema molekulare Biomarker finden Sie hier). Der nächste Schritt bei der Entwicklung tumoragnostischer Arzneimittel ist, die Tumore Histologie-übergreifend über molekulare Marker (tumoragnostisch) zu untersuchen und nicht nur wie bisher i.d.R. auf das betreffende Organ oder die Gewebezugehörigkeit zu fokussieren.

„Tumoragnostik ist ein vielversprechender Ansatz, der ein großes Potenzial vor allem für Patient:innen mit weniger häufigen Tumorentitäten oder bei seltenen Krebserkrankungen bieten kann – also überall dort, wo es noch keine ausreichend wirksamen Therapieoptionen gibt. Tumoragnostische Ansätze sind hier eine zentrale Strategie, die wir bei der Erforschung präzisionsonkologischer Arzneimittel verfolgen.“
Dr. Nils Krochmann,
Medizinischer Direktor Solide Tumore, Janssen Deutschland
Heute sind bereits verschiedene Genveränderungen identifiziert, die bei Tumoren in verschiedenen Entitäten eine relevante Rolle spielen und als Ziele für tumoragnostische Therapieansätze in Frage kommen. Die folgende Tabelle gibt einen Überblick zu derzeit bekannten Histologie-unabhängigen molekularen Biomarkern, die im Fokus der Forschung stehen (Auswahl).
AKT1-Mutationen | HER2-Mutationen | PDGFRA/B-Fusionen |
ALK-Fusionen | HER3-Mutationen | PD-L1-Überexpression |
APOEC | KIT-Mutationen | PD-L1-Amplifikation |
BRAF-Mutationen | KRAS-Mutationen | PIK3CA-Mutationen |
BRCAness | MET-Aberrationen | POLE-Mutationen |
dMMR | MSI-H* | RET-Aberrationen |
EZH2-Mutationen | NRG1-Aberrationen | ROS1-Aberrationen |
| FGFR-Aberrationen | NTRK1/2/3-Fusionen* | TMB-H* |
Tabelle 1: Potenzielle Biomarker für eine tumoragnostische Behandlung (Auswahl); *Biomarker mit tumoragnostischer Zulassung; modifiziert nach 4
Bei der Untersuchung tumoragnostischer Ansätze können sogenannte „Basket-Studien“ dem gewebe- und organunabhängigen Ansatz Rechnung tragen. Die Idee ist das Aufsetzen einer klinischen Studie, in der wie in einem Korb verschiedene Tumorentitäten „gesammelt“ werden, deren Gemeinsamkeit über eine bestimmte Genveränderung definiert wird. Für das Design von Basket-Studien eignen sich in der Regel einarmige Phase-I- oder Phase-II-Studien, um zum Beispiel erste Hinweise zu Wirksamkeit und Sicherheit von Medikamenten bei verschiedenen Tumoren mit demselben Biomarker zu erhalten.
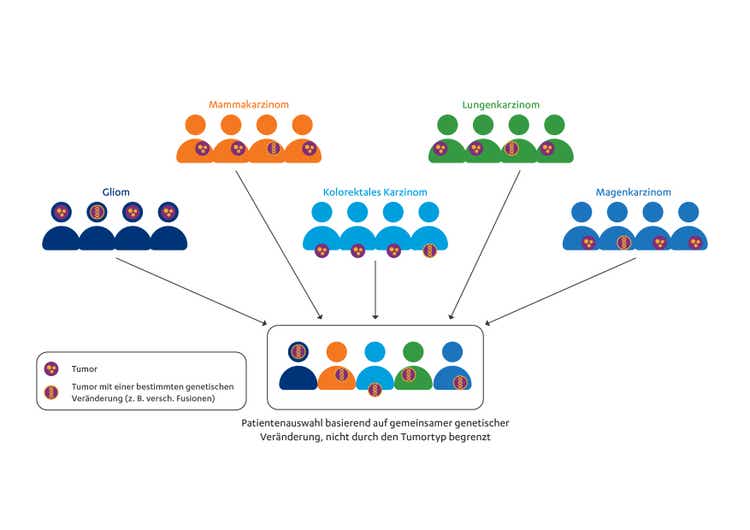
Abb. 1: Prinzip der Basket-Studien, bei denen die Auswahl der Teilnehmer auf Grundlage einer gemeinsamen onkogenen molekularen Alteration beruht, aber unabhängig von der Tumorhistologie und -lokalisation ist; modifiziert nach 5
Durch das heute bessere molekulare Verständnis und den oftmals bereits möglichen Nachweis der oben erwähnten Genveränderungen können und sollten Tumorerkrankungen individuell betrachtet werden. Klassisch randomisierte Studien stoßen bei der Erforschung genetischer Merkmale und der zielgerichteten Behandlung dieser Erkrankungen jedoch oft an ihre Grenzen. Insbesondere wenn die Patientenpopulationen mit seltenen Genveränderungen zu klein für eine erfolgreiche Rekrutierung in eine zweiarmige vergleichende Studie sind, können Basket-Studien eine echte Alternative zu den randomisierten Phase-III-Studien sein. Denn in der Summe können die seltenen Alterationen in den verschiedenen Tumoren ausgesprochen relevant sein, so dass die Zusammenführung der für jede Tumorentität geringen Anzahl an Patient:innen zusammen in dem „Korb“ zu einer aussagekräftigen Größe wachsen kann. Somit können zielgerichtete Therapieansätze zukünftig auch bei Patient:innen mit seltenen Genveränderungen untersucht werden, um auch in diesen Indikationen Fortschritte in der Behandlung zu erzielen.
Es muss an dieser Stelle allerdings festgehalten werden, dass dieser Ansatz mit seinem explorativen Charakter zunächst einmal hypothesengenerierend ist. Zwar werden in den regulatorischen Prozessen erste Basket-Studien akzeptiert, jedoch sollten ihre Ergebnisse für die bestmögliche Aussagekraft im Idealfall mittels konfirmatorischer Studien, zum Beispiel durch kleine randomisierte Phase-II-Studien, validiert werden4. Zudem können Real-Word-Daten weitere Evidenz im Hinblick auf Wirksamkeit und Verträglichkeit erzeugen: Im Vergleich von Real-World-Daten mit Daten verfügbarer Arzneimittel in ähnlichen Patientenkollektiven kann schon in frühen Entwicklungsstadien das klinische Potenzial eines Wirkstoffs besser eingeschätzt werden.
„In der strukturierten Analyse von Real-World-Daten steckt aus unserer Sicht ein enormes Potenzial für die Weiterentwicklung der Präzisionsonkologie und die schnelle Verfügbarkeit von Innovationen im Versorgungsalltag. So ermöglicht Real-World-Evidenz uns eine zeit- und kosteneffiziente Bewertung von Wirksamkeit und Verträglichkeit neuer Therapien in einem – verglichen mit randomisierten klinischen Studien – sehr heterogenen Kollektiv.“
Dr. Nils Krochmann,
Medizinischer Direktor Solide Tumore, Janssen Deutschland
Mehr zur Bedeutung von Real-World-Daten in der Präzisionsonkologie lesen Sie hier.
Quellen
- Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e. V. (DGHO): NTRK-Inhibitoren als sog. tumoragnostische Arzneimittel, https://www.dgho.de/publikationen/stellungnahmen/gute-aerztliche-praxis/ntrk-inhibitoren/tumor-agnostische-arzneimittel-20200113.pdf; zuletzt aufgerufen November 2023.
- Morganti, S. et al. (2020). Role of Next-Generation Sequencing Technologies in Personalized Medicine. In: Pravettoni, G., Triberti, S. (eds) P5 eHealth: An Agenda for the Health Technologies of the Future. Springer, Cham. https://doi.org/10.1007/978-3-030-27994-3_8
- Berger MF, Mardis ER. The emerging clinical relevance of genomics in cancer medicine. Nat Rev Clin Oncol. 2018 Jun;15(6):353-365. doi: 10.1038/s41571-018-0002-6. PMID: 29599476; PMCID: PMC6658089.
- https://oncologypro.esmo.org/content/download/396422/7708688/1/Tips-Tricks-Basket-Trials.pdf; zuletzt aufgerufen November 2023.
- Li IW et al. Journal of Cancer Metastasis and Treatment 2020; 6: 14.
Unser Angebot erfüllt die afgis-Transparenzkriterien.
Die afgis-Zertifizierung steht für hochwertige Gesundheitsinformationen im Internet. Die Prüfung durch insgesamt zehn umfangreiche Kriterien bestätigt, dass die Janssen Medical Cloud den medizinischen Fachkreis über gesundheitsrelevante Themen in seriöser, aktueller und qualitätsgesicherter Weise informiert.
EM-148885